Soluciones
SOLUCIONES
Una
solución es una mezcla homogénea entre dos sustancias puras. Una solución está
formada por soluto y solvente, el soluto es el que se disuelve en el solvente.
Soluto
El soluto es la sustancia que se
disuelve en una solución. Por lo general, el soluto es un sólido, que se disuelve en una sustancia
líquida, lo que origina una solución líquida. En la solución, el soluto suele encontrarse en menor
proporción que el solvente.
Solvente
Es una sustancia química la cual es utilizada para
disolver el soluto, el solvente tiene que ser en mayor cantidad a comparación
del soluto
Importancia de la polaridad y el tipo de
enlace químico en las soluciones
En una
solución la polaridad de las sustancias, influye en la solubilidad del soluto
en el solvente, ya que las sustancias polares se diluyen en las que también lo
son, mientras que las no polares no se mezclan con las polares, pero sí con las
no polares.
La
diferencia entre una sustancia polar de una no polar o también llamada apolar,
es que las sustancias polares, son las que los elementos que constituyen a su
molécula tienden a tener una mayor electronegatividad entre ellos, los ejemplos
más comunes de una sustancia polar son: el agua (H2O), y los iones
qué tienen enlaces iónicos los hace polares.
Las sustancias
no polares usualmente son las que tienen un enlace químico covalente, y se forman entre dos átomos del mismo elemento o entre
átomos de diferentes elementos que comparten electrones de manera más o menos
equitativa.
El tipo
de enlace y polaridad en las sustancias que componen la solución influye en la
solubilidad entre soluto y solvente, para que estás sean miscibles entre sí.
Características de una solución verdadera
Las soluciones son mezclas homogéneas, si son heterogéneas no son soluciones sino suspensiones.
Poseen dos o más sustancias puras.
Siempre son transparentes, a menos de que se le agregué algún tipo de colorante.
A simple vista no pueden distinguirse los componentes que la constituyen.
La composición y concentración son variables.
Tipos de soluciones
Insaturadas
Cuando una solución contiene disuelto menos soluto del que puede disolver
el solvente, se dice que esta solución es no saturada o insaturada.
Saturadas
Las
soluciones son saturadas cuando contienen la cantidad máxima de soluto disuelto
en el solvente, dependiendo de la temperatura o presión.
Sobresaturadas
La solución sobresaturada es aquella en la que el solvente ha disuelto más soluto
del que puede disolver.
Imagen sobre los tipos de soluciones
Fuente: https://i0.wp.com/www.elgencurioso.com/wp-content/uploads/2021/09/solucion-saturada-insaturada-y-sobresaturada.png?fit=15001
Es la forma
de expresar la cantidad de soluto disuelta en una
cantidad dada de disolvente o de solución. Entre mayor sea la cantidad de soluto disuelta más
concentrada estará la solución. Las concentraciones de las soluciones se pueden
expresar físicamente y químicamente.
Unidades de concentración físicas
Las unidades físicas son unidades que expresan la proporción del soluto en masa, volumen
o partes en relación con la cantidad de disolvente. Estas medidas se multiplican por 100 y se expresan en porcentajes.
Estas son las unidades físicas de concentración:
Porcentaje en masa (%m/m)
Es la unidad de concentración que expresa el porcentaje de masa de soluto en relación a la masa de la solución total. Se divide la masa del soluto entre la masa de
solución, y se multiplica por 100.
Formula de (%m/m)
Ejemplo: ¿Cuál es el (%m/m) de KCl si se
disolvieron 25g de ese soluto en 150g de solución?
%m/m= (g de soluto/g de solución)*100
%m/m= (25g de KCl/150g de solución)*100= 16.67%
Conclusión: El %m/m de KCl en la solución es de 16.67% en 150g de
solución.
Porcentaje en volumen sobre volumen (%v/v)
Es la unidad de concentración física que expresa la proporción del volumen de soluto en relación al volumen de la solución. Se divide el volumen del soluto entre el volumen de la solución,
y se multiplica por 100. Se utiliza en una solución donde el solvente y
soluto son líquidos.
Formula de (%v/v)
Ejemplo: ¿Cuál es el (%v/v) al disolver 300ml
de etanol en 800ml de solución?
%v/v= (vol de soluto/vol de solución)*100
%v/v= (300ml de etanol/800ml de solución)*100= 37.5%
Conclusión: El %v/v de etanol en la solución es del 37.5% en 800ml de
solución.
Porcentaje en masa sobre volumen (%m/v)
Es la unidad de concentración física que expresa la proporción de masa de soluto en relación al
volumen de la solución. Se divide la masa del soluto entre los mililitros de
solución, y se multiplica por 100.
Formula de (%m/v)
Ejemplo: ¿Cuál es el (%m/v) al disolver 40g de
NaCl en 555ml de solución?
%m/v= (g de soluto/vol de solución)*100
%v/v= (40g de NaCl/555ml de solución)*100= 7.21%
Conclusión: El %m/v de NaCl en la solución es del 7.21% en 555ml de
solución.
Partes por millón (ppm)
Es una
unidad de concentración que se refiere a la cantidad de unidades de una
determinada sustancia que hay por cada millón de unidades del conjunto.
Fórmula de ppm
Fuente: https://www.aulafacil.com/uploads/cursos/6422/23848_ppm.jpg
Ejemplo: ¿Cuántas partes por millón de NaCl hay en una
solución, donde se disolvieron 0.01 gramos de esa sustancia en 45g de solución
Ppm= (g de
soluto/g de solución)*1,000,000
Ppm= (0.01
de NaCl/45g de solución)*1,000,000= 222.22 ppm
Conclusión: Hay 222.22
partes por millón de NaCl.
Video sobre problemas de unidades de concentración físicas:
Unidades de concentración química
Las unidades químicas de concentración son las que expresan la concentración de la solución por equivalentes de carácter químico que presenta el soluto o el solvente, comúnmente se utiliza el mol: Estás son las unidades químicas de concentración:
Molaridad (M)
Es una
unidad de concentración química que indica la cantidad de moles de soluto que se
encuentran disueltos en un litro de disolución. La molaridad se expresa con la expresión
“molar”.
Fórmula de Molaridad
Ejemplo: Calcule la molaridad de
una solución al disolver 8 moles de soluto en 25 litros de solución
M=moles de
soluto/litros de solución
M=8
moles/25 litros= 0.32 M
Conclusión: La concentración
de la solución es de 0.32 molar.
Molalidad (m)
Es una unidad química de concentración que expresa la cantidad de moles
de soluto que hay en cada kilogramo de solvente.
Fórmula de Molalidad
Ejemplo: Calcule la molalidad de
una solución que se prepara mezclando 10 moles de soluto en 10kg de solvente.
m=moles de
soluto/kg de solvente
m= 10
moles/10 kg de solvente= 1m
Conclusión: La
concentración de la solución es 1 molal.
Fracción molar
Es otra forma de medir la concentración que expresa la proporción en que se encuentra una sustancia respecto a los moles
totales de la disolución.
Fórmula de Fracción molar
Ejemplo: Calcular la fracción
molar de etanol de una solución formada por 7 moles de etanol y 17 moles de
agua
Moles totales=
7 moles etanol+17 moles de agua= 24 moles
x etanol=
moles de etanol/ moles totales
x etanol= 7
moles/24moles=0.29
Conclusión: La fracción
molar de etanol en la solución es 0.29
Normalidad (N)
Se define como el número de equivalentes de
soluto por litro de solución, depende si el soluto el ácido, base o sal. El peso
equivalente de un ácido es igual al peso molecular del ácido dividido entre el número
de equivalentes de hidrógenos en su fórmula. Para una base se obtiene
dividiendo el peso molecular de la base entre el número de equivalentes de hidróxidos
(OH). Para las sales se obtiene de la división entre el peso molecular de la
sustancia, dividido la carga del catión.
Fórmula de Normalidad
Ejemplo: Calcule la normalidad
de una solución formada por 40 gramos de NaCl en 0.5 litros de solución.
N= No.
EQ/litros de solución
PEQ de
NaCl= 58.45g/1= 58.45g
40g de NaCl*(1 EQ/58.45)=0.684 EQ
N= No.EQ/litros de solución= 0.684/0.5= 1.37 N
Conclusión: La normalidad de la solución es 1.37 normal.
Video sobre problemas de unidades de concentración química:
Conclusión
Las soluciones químicas son muy importantes en la vida cotidiana, ya que se utilizan productos o alimentos, de uso y de consumo diario que son soluciones. Las soluciones también son utilizadas en la agricultura, en la aplicación de fertilizantes o sustancias químicas que sirven para potenciar la producción de los cultivos agrícolas. Las soluciones químicas son muy utilizadas en la mayoría de procesos donde haya sustancias químicas, que formen mezclas homogéneas entre ellas, entre dos o más sustancias.
Referencias Bibliográficas
Álvarez, D. O. (2021). Concepto
. Obtenido de Concepto: Soluciones. https://concepto.de/solucion-quimica/
Education, I. O. (2020). Euroinnova. Obtenido de Euroinnova:
Unidades de concentración de las soluciones.
https://www.euroinnova.edu.es/blog/que-es-la-concentracion#:~:text=qu%C3%ADmicas%20de%20concentraci%C3%B3n%3A-,Unidades%20f%C3%ADsicas%20de%20concentraci%C3%B3n,y%20se%20expresan%20en%20porcentajes.
Morales, A. (2021). Significados . Obtenido de Significados : Tipos
de soluciones https://www.significados.com/solucion-quimica
Universidad ICESI. (2021). Eduteka . Obtenido de Eduteka :
Soluciones químicas https://eduteka.icesi.edu.co/proyectos.php/1/8819




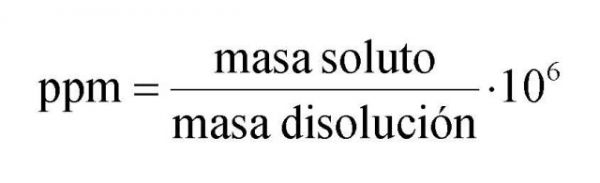


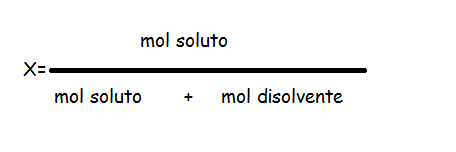

Comentarios
Publicar un comentario